肥胖及其相关代谢疾病,如2型糖尿病和胰岛素抵抗,已成为全球性的公共卫生问题。这些疾病不仅严重影响患者的生活质量,还给医疗系统带来了巨大的经济负担。因此,寻找有效的干预靶点和治疗策略,对于预防和治疗肥胖及其相关代谢疾病具有重要意义。CD44是一种跨膜蛋白,在细胞外信号转导至细胞内信号级联中起关键作用,相关研究大多集中于癌细胞。然而,CD44在代谢调节中的作用,尤其是在白色脂肪组织脂肪生成中的影响尚不清楚。
近日,孙诚教授课题组在《美国病理学杂志》(The American Journal of Pathology)上发表了题为“Ablation of CD44 Attenuates Adipogenesis in White Adipocytes via the Tryptophan 5-Hydroxylase 2/5-Hydroxytryptamine Axis to Protect Mice from High-Fat Diet-Induced Obesity”的研究论文。该研究揭示了CD44在白色脂肪组织(WAT)脂肪生成中的关键作用,并探讨了其潜在机制。
课题组前期通过高脂饮食(HFD)诱导的肥胖小鼠模型发现,肥胖小鼠的腹股沟和附睾白色脂肪组织中CD44的表达显著增加。进一步的研究表明,CD44的缺失或中和显著抑制了体外培养的脂肪细胞的脂肪生成。体内实验发现,CD44缺失小鼠对高脂饮食诱导的肥胖和代谢功能障碍表现出抵抗性。这些小鼠的体重增长、血糖水平、胰岛素水平以及脂肪组织质量均显著低于野生型小鼠。同时,CD44缺失还改善了葡萄糖耐量和胰岛素敏感性(图1)。
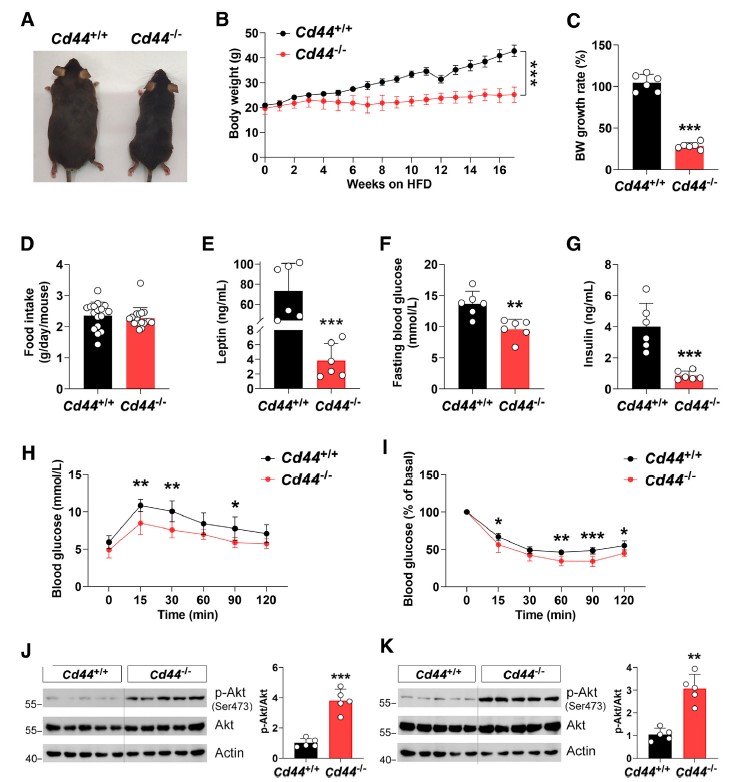
图1. CD44缺乏可减轻高脂肪饮食(HFD)小鼠的体重增加并改善葡萄糖稳态。
为了深入探究CD44在脂肪生成中的作用机制,研究团队对CD44缺失小鼠的eWAT进行了RNA测序。结果显示,CD44缺失导致白色脂肪组织中色氨酸羟化酶2(Tph2)的表达降低,进而抑制了脂肪生成。外源性补充5-羟色胺(5-HT,Tph2的产物)能够部分挽救由CD44中和引起的脂肪生成抑制。此外,使用p-氯苯丙氨酸(pCPA)抑制Tph2活性,能够重现CD44缺失小鼠的有益表型。进一步的研究表明,CD44的细胞内结构域(CD44-ICD)能够刺激Tph2启动子驱动的荧光素酶活性,因而调控Tph2的表达。此外,使用pCPA抑制Tph2活性同样能够保护小鼠免受高脂饮食诱导的肥胖,并改善葡萄糖稳态。
综上所述,该研究首次阐明了CD44在白色脂肪组织脂肪生成中的关键作用,并通过5-羟色胺轴揭示了其潜在机制(图2)。CD44及其下游靶标Tph2可能成为治疗肥胖及其相关代谢疾病(如胰岛素抵抗和2型糖尿病)的新靶点。这一发现为开发新的抗肥胖疗法提供了理论依据和实验支持。
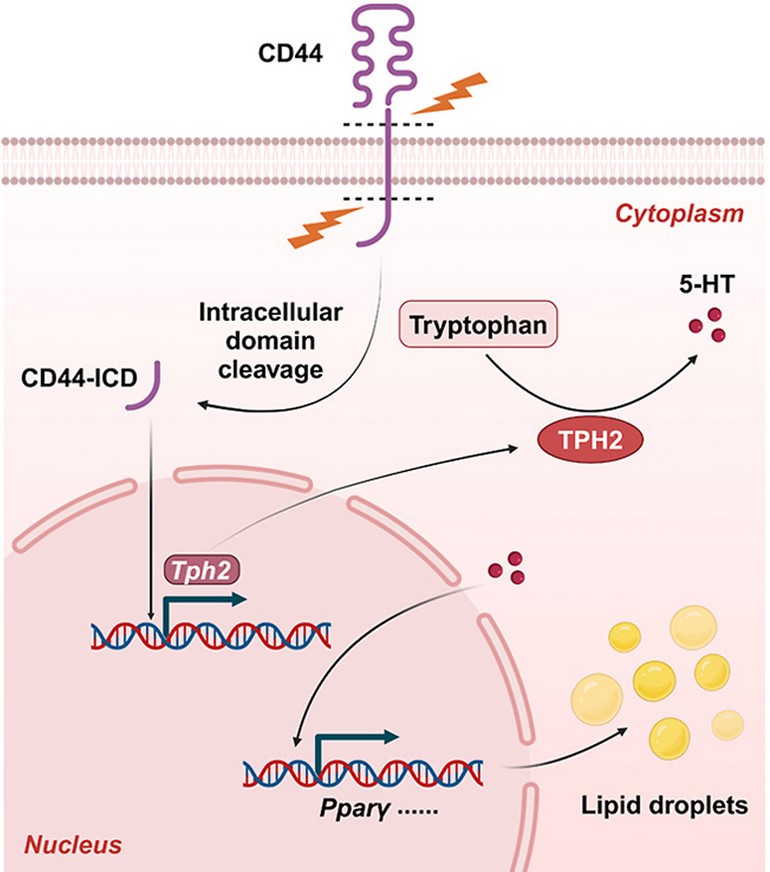
图2. CD44调控Tph2基因表达,促进脂肪生成的机制示意图
南通大学神经再生重点实验室孙诚教授为该论文通讯作者,南通大学附属医院老年科罗镧主任为共同通讯作者。硕士研究生吴钰婷和博士研究生马瑾瑜为第一作者。本研究获得了国家自然科学基金(32271193)、江苏省医学科研项目(YJXYY202204-XKA03)、南通市卫生健康委员会研究项目(Ym2023113,M2020033)和江苏省高校优势学科建设工程的资助。
原文链接:10.1016/j.ajpath.2024.10.005


