脊髓损伤(spinal cord injury, SCI)通常引发过度的炎症反应,导致继发性组织损伤,并加剧患者感觉和运动功能丧失,临床上目前仍缺乏有效的神经保护手段。值得注意的是,脊髓损伤的严重程度与损伤部位产生的炎症反应强度存在密切关联。然而,脊髓组织中感知脊髓损伤程度并诱发相应强度炎症反应的特定细胞类型和潜在的分子机制,至今尚未阐明。
近期,王勇军教授课题组在《先进科学》(Advanced Science)期刊在线发表了题为“Astrocytic ET-1 System Determines Microglia Phenotype Following Spinal Cord Injury”的重要研究。
该课题组前期工作发现,脊髓损伤部位凝血酶的激活在驱动炎症反应及继发性组织损伤进程中扮演关键角色,并且凝血酶的激活水平与脊髓损伤程度及血脊髓屏障破坏程度相关。脊髓损伤后,反应性星形胶质细胞通过其膜表面PAR-1受体感知凝血酶的活性变化,进而调控不同强度和类型趋化因子的有序生成,持续引导炎症细胞向损伤区域迁移(Brain Behav Immun, 2024)。
基于此,该研究团队进一步发现,在大鼠脊髓损伤模型中,凝血酶经由PAR-1受体激活星形胶质细胞ET-1系统。随后,星形胶质细胞来源的ET-1通过与小胶质细胞上的ETA和ETB受体结合,激活转录共激活因子YAP,促使急性期小胶质细胞向促炎的M1表型极化。实验证明,选择性抑制PAR-1或ET-1活性,能够显著减少损伤处M1型炎症细胞数量,并有效改善大鼠的后肢运动功能(图1)。
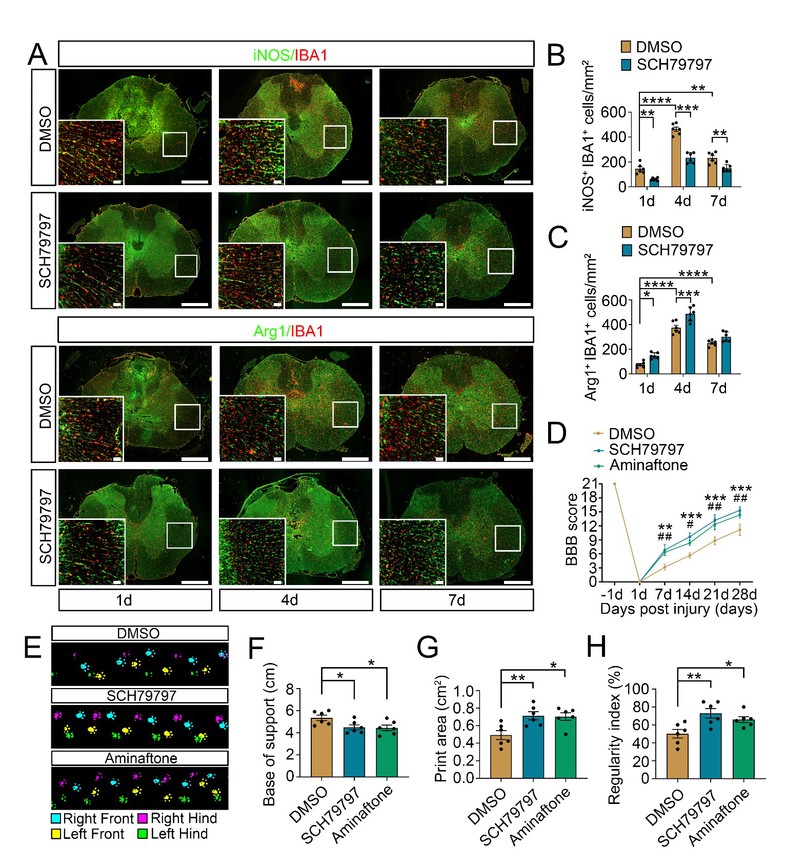
图1 PAR-1或ET-1抑制剂的药物治疗改善了脊髓损伤后大鼠的运动功能
综上所述,本研究首次阐明,脊髓损伤后凝血酶通过激活星形胶质细胞ET-1系统,进而促进小胶质细胞向M1表型极化的关键分子机制(图2)。具体通路为:脊髓损伤诱导凝血酶激活,随后通过RhoA/NF-κB和MAPKs/NF-κB信号通路激活星形胶质细胞ET-1系统;星形胶质细胞释放ET-1,通过与小胶质细胞ETA和ETB受体结合,调控YAP信号,促进损伤区域小胶质细胞向M1型极化,从而加剧损伤脊髓的病理进程。重要的是,脊髓损伤后应用PAR-1或ET-1抑制剂可显著减少M1型小胶质细胞的数量,并明显改善大鼠的后肢运动功能。这一发现为开发脊髓损伤的神经保护新疗法提供了新的药物靶点和干预策略。
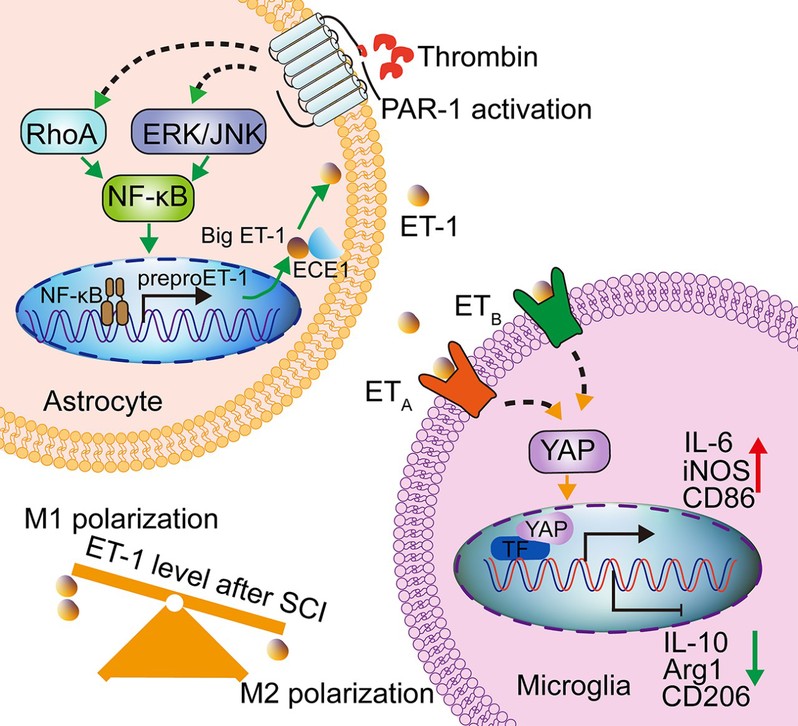
图2 脊髓损伤后凝血酶激活星形胶质细胞ET-1系统,促进小胶质细胞向M1表型极化的机制示意图
南通大学神经再生重点实验室王勇军教授为该论文通讯作者,何兵强博士为第一作者。本研究获得了国家自然科学基金(32471191)、南通市科技项目(JC2023047)、南通市卫生健康委员会研究项目(MS2023076)和江苏省研究生科研与实践创新计划(KYCX23_3412)的资助。
原文链接: https://doi.org/10.1002/advs.202507215


